Tóm tắt
Sâm bố chính không những là một loài hoa đẹp mà còn là một loài cây có giá trị dược liệu cao, được sử dụng nhiều trong đông y. Nghiên cứu này được thực hiện nhằm hoàn thiện quy trình vi nhân giống cây sâm bố chính từ hạt và đốt thân. Kết quả thu được cho thấy, mẫu hạt và đốt thân được khử trùng với dung dịch javel 15% trong 15 phút thu được tỷ lệ mẫu không nhiễm và sống sót đạt 71,99%. Tỷ lệ nảy mầm của hạt được nâng cao (82%) khi hạt được xử lý bằng cách ngâm trong dung dịch GA3 20 mg/L trong 120 phút trước khi tiến hành khử trùng. Môi trường thích hợp cho quá trình nhân nhanh chồi là môi trường MS (Murashige and Skoog, 1962)và chiều dài trung bình rễ đạt 13 cm sau 45 ngày nuôi cấy
MỞ ĐẦU
Sâm bố chính (Hibiscus sagittifolius Kurz) là loài cây dược liệu quý có tác dụng chữa cơ thể suy nhược, kém ăn, thiếu ngủ, đau lưng, đau mình, các chứng ho sốt nóng, trong người khô, táo bón, khát nước, gầy còm... (Đỗ Tất Lợi, 2004). Trong rễ sâm bố chính chứa phytosterol, coumarin, acid béo, acid hữu cơ, đường khử và hợp chất uronic; hàm lượng lipid là 3,96%; hàm lượng protein toàn phần là 0,23%; hàm lượng protid là 1,26%; hàm lượng tinh bột 15,14% và chất nhầy là 18,92% (chất nhầy là Dglucose và L-rhamnose). Các acid amin gồm 11 chất, trong đó có histidin, arginin, threonin, alanin, prolin, tyrosin, valin, phenylalanin và leucin; ngoài ra, còn có 13 nguyên tố khoáng cần thiết cho cơ thể (Trần Công Luận và Bùi Trần Minh Phương, 2011).
Một nghiên cứu khác về sâm bố chính cho thấy, trong rễ sâm bố chính còn chứa tinh bột và 30-40% chất nhầy (Đỗ Tất Lợi, 2004). Bên cạnh tác dụng dược liệu, sâm bố chính còn được người dân trồng làm cảnh với màu hoa khác nhau từ đỏ, hồng đến vàng. Với những công dụng và lợi ích trên mà sâm bố chính ngoài tự nhiên đang bị khai thác một cách quá mức làm cạn kiệt nguồn sâm trong tự nhiên. Do vậy, các nghiên cứu nhân giống, gây trồng loài cây này đang ngày càng được quan tâm. Trong đó, ứng dụng nuôi cấy mô tế bào thực vật trong công tác vi nhân giống có thể tạo ra các cây giống đồng nhất, có chất lượng tốt với số lượng lớn trong thời gian ngắn, là một giải pháp triển vọng trong quá trính phát triển loài dược liệu này, góp phần đảm bảo nguồn dược liệu cho sản xuất quy mô lớn cũng như bảo tồn loài sâm bố chính.
2 VẬT LIỆU VÀ PHƯƠNG PHÁP NGHÊN CỨU
2.1 Vật liệu
Vật liệu được sử dụng là các đoạn đốt thân sâm bố chính mang chồi ngủ có kích thước 2 cm và hạt cây sâm bố chính (Hibiscus sagittifolius Kurz) được thu nhận tại thành phố Cao Lãnh, tỉnh Đồng Tháp, Việt Nam.
2.2 Phương pháp nghiên cứu
2.2.1 Bố trí thí nghiệm
Khảo sát ảnh hưởng của thời gian khử trùng đoạn đốt thân và hạt sâm bố chính trong dung dịch HgCl2, NaClO
Đoạn đốt thân và hạt sâm bố chính được rửa sạch với nước trong 10 phút, sau đó khử trùng bằng cồn 70% trong 1 phút. Tiếp theo mẫu được khử trùng với dung dịch HgCl2 0,1% và NaClO 15% ở các khoảng thời gian khác nhau: 5; 10; 15; 20 phút. Sau khi khử trùng, tiến hành cấy 2 hạt/ống nghiệm (đối với mẫu hạt) và 1 mẫu/ống nghiệm (đối với mẫu đốt thân). Mỗi nghiệm thức thực hiện 10 ống nghiệm. Thí nghiệm được bố trí ngẫu nhiên với 3 lần lặp lại.
Ảnh hưởng của tiền xử lý GA3 đến khả năng nảy mầm của hạt sâm bố chính Hạt sâm bố chính được tiền xử lý bằng cách ngâm trong dung dịch GA3 ở các nồng độ khác nhau (0; 10; 20; 30; 40 mg/L) trong 2 giờ trước khi tiến hành khử trùng. Thời gian và nồng độ chất khử trùng được chọn từ công thức tối ưu nhất ở thí nghiệm trên. Ở hai thí nghiệm trên, môi trường nuôi cấy đốt thân là môi trường MS (Murashige and Skoog, 1962) có bổ sung 1,0 mg/L BA, 30 g/L sucrose, 8 g/L agar, pH 5,8. Môi trường nuôi cấy hạt là MS có bổ sung 10 mg/L GA3, 30 g/L sucrose, 8 g/L agar, pH 5,8 (Phan Duy Hiệp và ctv., 2014). Tiến hành theo dõi và thu nhận số liệu sau 20 ngày nuôi cấy.
Ảnh hưởng của BA đến khả năng nhân nhanh chồi sâm bố chính
Các chồi in vitro thu nhận ở thí nghiệm trên (bật chồi từ đốt thân và cây nảy mầm từ hạt) được cắt thành những đoạn thân có mang chồi bên với kích thước khoảng 1,5 cm. Sau đó, mẫu đốt thân được nuôi cấy ở môi trường MS có bổ sung 30 g/L sucrose, 100 mL/L nước dừa, 8 g/L agar, pH 5,8 (Phan Duy Hiệp và ctv., 2014) đồng thời bổ sung BA với các nồng độ khác nhau: 0, 1, 2, 3, 4 mg/L. Số liệu được thu nhận sau 45 ngày nuôi cấy.
Ảnh hưởng của NAA đến khả năng ra rễ của cây sâm bố chính
Các chồi in vitro có kích thước khoảng 3 cm thu nhận từ môi trường tối ưu ở giai đoạn nhân nhanh được tách riêng lẻ và cấy vào môi trường MS có bổ sung 30 g/L sucrose, 8 g/L agar, pH 5,8 và bổ sung NAA với các nồng độ khác nhau: 0; 0,5; 1,0 ; 1,5; 2,0 mg/L. Số liệu được thu nhận sau 45 ngày nuôi cấy.
2.2.2 Điều kiện nuôi cấy
Thí nghiệm được thực hiện trong điều kiện nhiệtđộ 25 ± 2oC, cường độ chiếu sáng 2.500 ± 200 lux, thời gian chiếu sáng 12 giờ/ngày, độ ẩm phòng nuôi cây 50 - 60%.
2.2.3 Xử lý thống kê
Thí nghiệm được bố trí theo kiểu ngẫu nhiên hoàn toàn (CRD) với 3 lần lặp lại. Các số liệu được xử lý thống kê bằng phần mềm Microsoft Excel và Statgraphic Centurion XVI với độ tin cậy 95%.
3 KẾT QUẢ VÀ THẢO LUẬN
3.1 Ảnh hưởng của thời gian khử trùng đốt thân và hạt sâm bố chính trong dung dịch HgCl2 và NaClO
Khi sử dụng dung dịch HgCl2 0,1%, tỷ lệ mẫu không nhiễm đều đạt 100% ở cả mẫu đốt thân và hạt, nhưng tất cả các mẫu nuôi cấy đều không bật chồi hoặc nảy mầm (Hình 1, 2). Nguyên nhân là do HgCl2 là một chất khử trùng mạnh, nên không chỉ gây chết đối với vi sinh vật mà còn gây chết đối với mẫu mô tế bào thực vật. Kết quả này cũng tương tự với quan sát của Wesely et al. (2012) khi khử trùng tạo mẫu sạch từ chồi non cây ngưu tất (Achyranthes bidentata) sử dụng HgCl2 0,1% trong thời gian 5 phút cho tỷ lệ mẫu sạch đạt 100%, nhưng 95 – 100% mẫu bị chết.
Đối với nghiệm thức sử dụng NaClO 15%, kết quả khử trùng đoạn đốt thân cho thấy tỷ lệ mẫu không nhiễm đạt 71,99% và tất cả các mẫu đốt thân không nhiễm đều tạo chồi ở nghiệm thức 15 phút. Ở nghiệm thức 20 phút, tỷ lệ mẫu đốt thân không nhiễm đạt cao nhất (100%), tuy nhiên tỷ lệ mẫu bật chồi chỉ đạt 8% (Hình 1). Ở hai nghiệm thức 5 và 10 phút, tỷ lệ mẫu không nhiễm thấp, chỉ đạt lần lượt là 4 và 44% và tỷ lệ mẫu bật chồi tương ứng của hai nghiệm thức là 4% và 40%. Do đó, thời gian khử trùng mẫu đốt thân trong dung dịch NaClO thích
hợp là 15 phút. Nguyễn Văn Việt và ctv. (2016) khi nghiên cứu khử trùng mẫu đốt thân cây Aerides odorata Lour bằng NaClO cũng cho thấy, nếu khử trùng với NaClO thì thời gian khử trùng 17 phút thu được tỷ lệ mẫu sạch đạt 83,33% và tỷ lệ mẫu tái sinh là 60,67%.
 |
Hình 1: Ảnh hưởng của thời gian khử trùng đoạn đốt thân trong dung dịch HgCl20,1% và NaClO15
|
Mẫu hạt được khử trùng với dung dịch NaClO 15% cũng thu được kết quả tương tự với mẫu đốt thân. Ở các mức thời gian từ 5 đến 20 phút, tỷ lệ mẫu hạt không nhiễm gia tăng tỷ lệ thuận với thời gian khử trùng và đạt cao nhất (88%) ở nghiệm thức 20 phút; tuy nhiên, tỷ lệ hạt nảy mầm ở nghiệm thức này thấp (14,67%). Ở nghiệm thức 15 phút, tỷ lệ hạt không nhiễm là 76% và tỷ lệ mẫu sống sót đạt cao
nhất (71,99%). Dựa trên kết quả nghiên cứu cho thấy, thời gian khử trùng có ảnh hưởng nhiều đến hiệu quả khử trùng và khả năng sống sót của mẫu nuôi cấy.Vì vậy, thời gian khử trùng mẫu hạt thích hợp trong dung dịch NaClO 15% là 15 phút. Theo nghiên cứu của Yildiz and Er (2002), hạt của cây lanh (Linum usitatissimum) được khử trùng bằng NaClO kết hợp với nhiệt độ 10oC sẽ cho hiệu quả tối ưu nhất với tỷ lệ nảy mầm của hạt là 100%.
Như vậy, chất khử trùng thích hợp cho cả mẫu hạt và đốt thân là NaClO 15% với thời gian khử trùng 15 phút.
 |
Hình 2: Ảnh hưởng của thời gian khử trùng hạt sâm bố chính trong dung dịch HgCl20,1% và
NaClO15%
|
3.2 Ảnh hưởng của tiền xử lý GA3 đến khả năng nảy mầm của hạt sâm bố chính
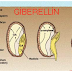
Trong nghiên cứu này, nhằm tăng khả năng nảy mầm nên các hạt sâm đều được xử lý bằng GA3 trước khi nuôi cấy ở các nồng độ khác nhau. Sau 20 ngày nuôi cấy, các mẫu hạt được tiền xử lý bằng cách ngâm trong dung dịch GA3 ở các nồng độ từ 10 – 30 mg/L đều thu được tỷ lệ hạt nảy mầm cao hơn so với mẫu không xử lý với GA3 trước đó hoặc xử lý với GA3 ở nồng độ cao (40 mg/L), và tỷ lệ hạt nảy mầm đạt cao nhất (82%) ở nồng độ 20 mg/L GA3.
Kết quả thu được cho thấy nồng độ GA3 ảnh hưởng đến tỷ lệ nảy mầm của hạt. Phan Duy Hiệp và ctv. (2014) cũng báo cáo, tiền xử lý hạt sâm bố chính với dung dịch GA330 mg/L trong thời gian 120 phút, đã giúp nâng cao tỷ lệ nảy mầm của hạt (55,60%).
 |
| Bảng 1: Ảnh hưởng của nồng độ GA3 tiền xử lý đến khả năng nảy mầm của hạt sâm bố chính |
 |
Hình 3: Ảnh hưởng của nồng độ GA3 tiền xử lý đến khả năng nảy mầm của hạt sau 20 ngày nuôi cấy
A; B; C; D; E tương ứng với nồng độ GA3: 0; 10; 20; 30; 40 mg/L |
Ngoài ra, GA3 cũng ảnh hưởng đến chiều cao của cây thu được. Ở nghiệm thức hạt không được tiền xử lý với GA3, cây thu được có chiều cao thấp hơn hẳn so với các nghiệm thức có xử lý với GA3 (Hình 3). Như vậy, tiền xử lý hạt với GA3 (20 mg/L) giúp nâng cao tỷ lệ nảy mầm cũng như chiều cao của cây con.
3.3 Ảnh hưởng của BA đến khả năng nhân nhanh chồi sâm bố chính
Nhân nhanh chồi là một giai đoạn quan trọng trong việc nhân giống tạo ra số lượng lớn cây in vitro. Các thể chồi sau khi hình thành có khả năng tiếp tục hình thành chồi với số lượng và chất lượng phụ thuộc rất nhiều vào môi trường nuôi cấy.
Trong nghiên cứu này, khi bổ sung BA vào môi trường nuôi cấy từ 0 - 2 mg/L thì số lượng chồi/mẫu tăng từ 1,20 lên 6,60 chồi/mẫu và chiều cao chồi cũng tăng từ 2,28 lên 3,28 cm. Tuy nhiên, nồng độ BA cao cũng gây ức chế sự phát triển của chồi, nên khi tăng nồng độ BA lên 3 - 4 mg/L thì số lượng chồi và chiều cao chồi giảm xuống (Bảng 2, Hình 4).
 |
| Bảng 2: Ảnh hưởng của BA lên khả năng nhân nhanh chồi sau 45 ngày nuôi cấy |
 |
Hình 4: Ảnh hưởng của BA đến khả năng nhân nhanh chồi của sâm bố chính sau 45 ngày nuôi cấy
A; B; C; D; E tương ứng với nồng độ BA: 0; 1,0; 2,0; 3,0; 4,0 mg/L |
3.4 Ảnh hưởng của NAA đến khả năng ra rễ của cây sâm bố chính
Tạo rễ là bước cuối cùng trong quy trình tạo cây in vitro hoàn chỉnh. Có nhiều loại auxin được sử dụng trong giai đoạn tạo rễ, trong đó NAA là một loại auxin tổng hợp và có hoạt tính mạnh được ứng dụng nhiều trong nuôi cấy mô tế bào thực vật. Nhiều nghiên cứu cũng đã báo cáo, sử dụng NAA thích hợp cho giai đoạn ra rễ tạo cây con hoàn chỉnh, như nghiên cứu của Vũ Hoài Sâm và ctv. (2016) khi tiến hành nghiên cứu nhân giống in vitro cây bách hợp (Lilium brownii F.E. Brown) cũng đã chỉ ra rằng trong môi trường có bổ sung 1,0 mg/L NAA cho kết quả tạo rễ tối ưu nhất. Trên đối tượng cây hà thủ ô đỏ, Lin et al., 2003 cũng nhận thấy nếu bổ sung NAA vào môi trường thì sau 45 ngày nuôi cấy tỷ lệ mẫu tạo rễ là tối ưu nhất 97%.
Trong nghiên cứu này, kết quả thu được cho thấy, số lượng rễ phụ thuộc vào nồng độ NAA bổ sung vào môi trường nuôi cấy. Ở nghiệm thức đối
chứng, mẫu chồi vẫn tạo rễ, tuy nhiên số lượng rễ tạo ra thấp (6,6 rễ/mẫu), hình thái rễ mảnh với chiều dài trung bình là 13,6 cm, cây yếu và ít lá (Hình 5A). Khi tăng nồng độ NAA từ 0,5 đến 1,5 mg/L thì số lượng rễ/mẫu cũng tăng dần lên và số lượng rễ đạt cao nhất ở nồng độ 1,5 mg/l với 34,8 rễ/mẫu; tuy nhiên, ở nồng độ NAA 1,5 mg/L rễ thu được ngắn hơn so với nồng độ 0,5 và 1,0 mg/L. Nếu tiếp tục tăng nồng độ NAA lên 2,0 mg/L thì số lượng rễ giảm (22,0 rễ/mẫu), đồng thời cây phát triển kém, thấp hơn so với các nghiệm thức khác. Ở nồng độ 1,0 mg/L NAA thu được 33,6 rễ/mẫu và chiều dài là 13,0 cm, rễ tạo ra dày, to, khỏe mạnh, đồng thời cây xanh, khoẻ mạnh (Bảng 3, Hình 5). Do đó, nồng độ NAA 1,0 mg/L được chọn là phù hợp cho quá trình hình thành rễ tạo cây hoàn chỉnh ở cây sâm bố chính.
 |
| Bảng 3: Ảnh hưởng của NAA đến khả năng ra rễ của sâm bố chính |
 |
Hình 5: Ảnh hưởng của NAA đến khả năng tạo rễ của sâm bố chính
A; B; C; D; E tương ứng với nồng độ NAA: 0; 0,5; 1,0; 1,5; 2,0 mg/L |
4 KẾT LUẬN
NaClO 15% thích hợp cho quá trình khử trùng hạt và đốt thân sâm bố chính để thu nhận nguồn mẫu in vitro, với thời gian khử trùng là 15 phút. Tiền xử lý hạt với dung dịch GA3 ở nồng độ 20 mg/L trong 120 phút giúp nâng cao tỷ lệ nảy mầm và chiều cao của cây con. Môi trường thích hợp cho quá trình nhân nhanh chồi sâm bố chính là môi trường MS có bổ sung 2 mg/L BA, 30 g/L sucrose, 100 mL/L nước dừa, pH 5,8. Môi trường thích hợp cho quá trình phát sinh rễ tạo cây con hoàn chỉnh là MS có bổ sung 1 mg/L NAA, 30 g/L sucrose, 8 g/L agar, pH 5,8
Tác giả
Trịnh Thị Hương1*, Võ Phan Nhật Khang1, Lê Trương Minh Châu1, Vạn Minh Hiệu1 và
Trần Trọng Tuấn2
1Khoa Công nghệ sinh học, Trường Đại học Công nghiệp Thực phẩm Thành phố Hồ Chí Minh
2Phòng Công nghệ tế bào thực vật, Viện Sinh học Nhiệt đới Thành phố Hồ Chí Minh